Gereç ve Yöntem
Bu projede Akdeniz’de önemli roller oynayan bakterilerin tanımlanması, topluluk yapılarının, bolluklarının, gerçekleştirdikleri biyokimyasal reaksiyonların hızlarının ve bu unsurlardaki zamansal dinamiklerin açıklığa kavuştururulması hedeflenmiştir. Söz konusu bakterilerin türleri, topluluk yapıları ve bollukları tüm dünyada sürekli artan bir ivme ile mikrobiyologlar tarafından tercih edilen ve bakterilerin kültür edilmesini gerektirmeyen metagenomik ve metatranskriptomik yaklaşımlar kullanılarak belirlenmiştir.
Bu bakterilerin gerçekleştirdikleri önemli reaksiyonların hızlarının tayini ise iki ayrı yöntem kullanılarak yapılmıştır. Kullanılan birinci yöntem biyokimyasal reaksiyon hızlarını belirlemek için kullanılan standart bir yöntem olan izotop analizi yöntemidir. Proje kapsamında reaksiyon hızlarını belirlemek için ikinci ve yeni bir yöntem geliştirilmiştir. Bu yöntem kapsamında kullanılan modelde mikroorganizmalar tarafından gerçekleştirilen reaksiyonların hızlarını belirleyen sabit parametreler sahada yapılan ölçümler kullanılarak belirlenmiş, bu reaksiyon hızlarındaki zamansal dinamikler model çıktıları kullanılarak tahmin edilmiştir. Reaksiyon hızlarının model kullanılarak belirlenmiş olması projenin yaygın etkisine önemli ek katkılar sağlamaktadır. Bu katkılardan biri modelin ölçüm yapılmayan zaman, yer ve derinliklerde de reaksiyon hızları ile ilgili tahmin yürütebiliyor olması, bir başka katkısı ise kullanılan modelin ileride gerçekleştirilmesi planlanan ve tüm Doğu Akdeniz’i kapsayan üç boyutlu model çalışmalarının temelini oluşturacak olmasıdır. Reaksiyon hızlarının izotop analizi yöntemi ile de tayini de, geliştirilen yeni yöntemin etkinliğinin test edilmesini sağlamıştır.
Mikroorganizmaların topluluk yapılarında ve gerçekleştirdikleri fonksiyonlardaki zamansal dinamiklerin açıklığa kavuşturulması ve özellikle bu kapsamda model parametrelerinin belirlenmesi birçok fiziksel, biyojeokimyasal ve genetik değerin yüksek sıklıkta ölçülmesini gerektirmektedir. Bu kapsamda yapılan ölçümler projenin önemli bir bölümünü oluşturmaktadır. Orta Doğu Teknik Üniversitesi Deniz Bilimleri Enstitüsü (ODTÜ-DBE) proje için gerekli olan fiziksel ve biyojeokimyasal parametrenin birçoğunun ölçümlerini hali hazırda Doğu Akdeniz’in Kuzey Levant baseninde bulunan zaman serisi istasyonlarında sürekli olarak sürdürmektedir. Aylık olarak ölçümlerin alındığı bu istasyonlar enstitü açıklarında bulunan Erdemli Zaman Serisi (ETS) istasyonları olarak adlandırılmıştır. Bu proje kapsamında önerilen yöntemler Doğu Akdeniz’in herhangi bir yerinde uygulanabilir yöntemlerdir. Buna karşın son 20 yılın büyük bir kısmını kapsayacak şekilde sık periyotlarda (aylık), önemli fiziksel ve biyojeokimyasal parametrelerin ölçümünün yapılmasından dolayı Erdemli Zaman Serisi çalışma sahası olarak tercih edilmiştir. Proje kapsamında yapılan tüm ölçümler 200m derinlikte bulunan ETS istasyonunda yapılmıştır. Kullanılan model ise verilerin model çıktıları ile karşılaştırılmasını mümkün kılmak amacıyla yine bu istasyon için geliştirilmiş ve çalışılmıştır.
Erdemli Zaman Serisi kapsamında ölçülen fiziksel ve biyokimyasal parametreler
Bu çalışma, Erdemli Zaman Serisi (ETS) izleme istasyonunda, 36o26.1694'N ve 34o20.7556'E koordinatlarında yer alan (Şekil 3) toplam su kolonu derinliği 200 metre olan istasyonda (ETS-200) yürütülmüştür. Bu bölümde kullanılan veriler Erdemli Zaman Serileri (ETS) olarak adlandırılan ODTÜ-IMS izleme çalışmaları çerçevesinde toplanmıştır. Tüm fiziksel ve biyojeokimyasal veriler, RV/Bilim2 ve RV/Lamas bilim insanlarının, teknisyenlerin ve mürettebat üyelerinin ortak çabalarıyla üretilmektedir. Fiziksel Parametreler
Tuzluluk, sıcaklık, yoğunluk, oksijen satürasyonu olarak deniz suyunun fiziksel özellikleri, ETS-200 m istasyonunda, bir rozet örnekleyicisine sabitlenmiş CTD - Seabird model-SBE 19 kullanılarak yerinde ölçülmüştür. Tuzluluk değerleri, in situ iletkenlik ve sıcaklık ölçümlerinden otomatik olarak hesaplanmaktadır. CTD probunun hassasiyeti sıcaklık için ± 0,005° C ve iletkenlik için ± 0,0005 S/m'dir.
Karışım tabaka derinliği, aktif türbülansın okyanusta birtakım derinlik aralıkları arasında homojenleştirildiği bir tabaka olarak belirlenir. Karışım tabaka kütlesi içinde momentum ve enerji aktarılır. Karışım tabaka derinliği (KTD), su kolonunun kimyasal ve biyolojik özellikleri üzerinde önemli bir etkiye sahiptir. KTD'yi hesaplamak için, seçilen kriter, 10m derinlikteki yoğunluğun eşik değerinde meydana gelen değişimdir. Dikkate alınan yoğunluktaki değişim 0,03 kg/m3'tür (de Boyer Montégut, 2004).
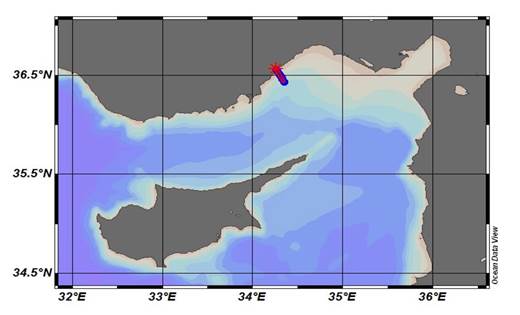
Şekil 3. Erdemli Zaman Serisi İstasyonlarının Yeri. Çalışma, nispeten kıyıdan uzak (kıyıdan 7 km uzaklıkta) ETS-200 metrelik istasyonunda yapılmıştır.
Işıklı Tabaka Derinliği Hesaplaması
Öfotik Bölge (Euphotic Zone-EZ)- Işıklı tabaka (IT) derinliğine ulaşmak için Fotosentetik Aktif Radyasyon (PAR) verileri kullanılmıştır (Kirk, 1994). IT derinliği, yüzey PAR değerinin %1'inin ulaştığı derinlik olarak tanımlanır. PAR sensörü, CTD rozet sisteminin üst kısmında bulunurken, basınç sensörü sistemin aşağı kısmında yer almaktadır. Bu iki sensör arasındaki mesafe 1,15 metredir. Bu mesafe nedeniyle IT derinliği yüzeyden (0m) değil 1m derinliğinden hesaplanmıştır. PAR (1m) verileriyle ilgili önemli bir konuda, ODTÜ-DBE iç raporunda belirtilen, PAR veri edinimindeki sorunlara ilişkindir. Sensörlerin fiziksel olarak yanlış hizalanması nedeniyle PAR (1m) havada elde edilen verilerle kontamine olabilmekte iken ve bazı ölçümler de 1m derinliğinde veri içermemektedir. Bu sorunun üstesinden gelmek için ODTÜ-DBE iç raporunda önerildiği üzere 50 veri noktası kullanılarak elde edilen 6. dereceden polinom denklemi ile ekstrapolasyon yapılmıştır. PAR1db’ın IT derinliğini tahmin etmek için başarıyla kullanılabileceği ve ortalama hata oranı da %10'un altında bildirilmiştir. Buna göre, ışıklı tabaka derinliği, hesaplanan PAR verisinden 1m derinliğe (EZ (0) = EZ (1m)) göre hesaplanmıştır.
İnorganik besin tuzları ve toplam klorofil ölçümleri
İnorganik besin tuzları örnekleri yüksek yoğunluklu polietilen şişelere (HDPE) belirli derinliklerden alınmış ve dört kanallı auto-analizör kullanılarak (Bran Luebbe) standart kalorimetrik yöntemlerle analiz edilene kadar -20 ° C'de derin dondurucuda saklanmıştır (Strickland ve Parsons, 1972). Nitrat + nitrit, silikat, fosfat ve amonyum için tespit limitleri sırasıyla şu şekildedir: 0,05 uM, 0,3 uM, 0,02 uM ve 0,05 uM. Toplam klorofil ölçümleri için uygun derinliklerdeki deniz suyu kahverengi polietilen şişelere alınmış ve hemen gemide GF/F filtrelerinde (1050 ml) süzülmüşlerdir. Analizden önce filtreler eritilmiş (Strickland ve Parsons, 1972) ve geleneksel spektroflorometrik yöntemler kullanılarak analiz edilmiştir (HITACHI fluorescence spectrophotometer F-2500). Örneklemenin yapıldığı derinlikler metre cinsinden şöyledir: 0, 10, 25, 50, 75, 100, 150, 200.
Bu analizlerin yapıldığı ODTÜ-DBE kimya laboratuvarları uluslararası QUASIMEME Z-skor testlerine başarıyla katılmıştır.
Doymuş oksijen içeriğinin, yüzde oksijen doygunluğunun ve görünür oksijen kullanımının hesaplanması
Okyanusdaki oksijen konsantrasyonları, su sütununun biyolojik aktivitesindeki değişikliklerin yanı sıra fiziksel özelliklerce de değişim gösterir. Solunum için fotosentez ve substrat ürünü olarak, biyolojik aktiviteyi belirlemek için oksijen dağılımı kullanılmıştır.
Fotosentez ürünü ve solunumun substratı olarak oksijen dağılımı, biyolojik aktiviteyi belirlemek için kullanılmıştır. Doymuş oksijen içeriği (saturated oxygen content-SOC), deniz yüzeyinde ve 1 atm basınçta bir litre deniz suyundaki oksijen içeriğidir. Herhangi bir ek oksijen çözünmesi oksijen çıkışıyla sonuçlanırken herhangi bir oksijen azalması fazladan oksijen çözünmesi ile sonuçlanır. Öte yandan, görünür oksijen kullanımı (Apparent oxygen utilization - GOK), parselin yüzeye çıktığı ve hipotetik olarak tamamen doygun hale getirilmesi için kullanılan oksijen miktarının bir tahminini sağlar.
Çeşitli birimlerde çözünmüş oksijenin çözünürlük değerlerinin hesaplanması için kullanılan denklemler UNESCO tavsiyelerine göre uygulanmıştır (UNESCO, 1986) ve (Weiss, 1970). Kullanılan denklemler ve sabitler aşağıdaki gibidir:
ln (SOC) = I + (J/T) + (K/T2) + (L/T3) + (M/T4) - S* (N + (P/T) + (Q/T2))
% SOC = [ O2 [m] / O2[SOC]) x 100] – 100
GOK = O2 [m] – O2[SOC]
burada;
T= Sıcaklık - Kelvin
S = Tuzluluk
O2 [m] = uM biriminde ölçülmüş oksijen konsantrasyonu
I = -135.90205
J = 1.575701 x 105
K= -6.642308 x 107
L = 1.243800 x 1010
M = -8.621949 x 1011
N = 0.017674
P = -10.754
Plankton topluluğu örneklemesi
Ekstra 100 ml deniz suyu borosilikat koyu şişelere, mikrobiyal topluluk analizi için DNA numunelerinin toplandığı aynı Niskin şişelerinden alınmıştır. Numuneler 2 ml’lik %25 glutaraldehit ile sabitlenmiş ve oda sıcaklığında bekletildikten sonra heterotrofik bakteriler ve Synechococcus spp. hücreleri sayılmış ve Ökaryotik fitoplankton türlerinin hücre sayımları ise ışık mikroskobu ile yapılmıştır. Daha iyi karşılaştırma yapılabilmesi için hücre bolluk ölçümleri biyo-kütle ölçümlerine çevrilmiştir. Heterotrophic bakteri ve Synechococcus spp. biyo-hacimleri Boran (2017) tarafından aynı örnekleme istasyonunda yapılan iki senelik çalışmadan alınmıştır (Boran, 2017). Biyo hacim için her derinlik ve ayın ortalama değerleri kullanılmıştır. Biyo-hacim ve hücre sayısı ölçümleri daha sonra heterotrofik bakteriler için (77 fgC/hücre) Carlson vd., (1999) tarafından önerildiği gibi ve Waterburry vd (1986) tarafından siyanobakteri için önerilen (123 fgC/hücre) değerler kullanılarak karbon kütlesi hesaplanmıştır. Fitoplankton hücrelerinin karbon biyo-kütle ölçümleri için ise hücre hacim değerleri (Arin vd., 2002; Fanuko ve Valcıc, 2009), Menden-Deuer ve Lessard (2000) tarafından önerilen formüller kullanılarak hesaplanmıştır (Tablo 1).
Proje kapsamında ölçülen ek biyokimyasal parametreler
ETS kapsamında halihazırda önemli fiziksel, kimyasal ve biyolojik parametreler ölçülmektedir. Bu projenin amaçlarına ulaşmada önemli olan diğer parametrelere ilişkin yöntemler aşağıda verilmiştir.
Organik madde, Toplam Fosfat, Toplam Azot örneklemesi ve ölçümleri
Organik madde örneklemeleri metagenomik çalışma ile aynı örnekleme derinliklerinden gerçekleştirilmiştir: yüzey, 25 m, 50 m 100 m 150 m ve 200 m. Toplamda iki litre deniz suyu, kahverengi polietilen şişelerle örneklenmiş ve her bir POK ve POA ölçümü için doğrudan GF/F filtrelerine filtrelenmiştir. Partikül organik karbon ve azot kuru yakma yöntemiyle Carlo Erba model 1108 CHN analizörü kullanılarak ODTÜ- DBE kimya laboratuvarlarında ölçülmüştür. Toplam fosfat ve toplam azot ölçümleri kalorimetrik olarak belirlenmiştir (Dilek Ediger vd., 2005).
Çözünmüş organik fosfat, aşağıda verilen denkleme göre toplam fosfat (TP), partikül fosfat (PP) ve inorganik fosfatın (IP) doğrudan ölçümlerinden hesaplanmıştır.
DOP =TP – (PP + IP)
Tablo 1. Biyokütle hesabı için fitoplankton topluluğunun biyo-hacmi, karbon ve azot içeriği
|
|
Hacim (mm3) |
Ref. |
PgC/hücre |
PgN/hücre |
Ref. |
|
Nanoflagellates |
93* |
(Arin vd., 2002) |
12.87939123 |
5.536585657 |
(Menden-Deuer ve Lessard, 2000) |
|
Coccolithophoride |
265* |
(Arin vd., 2002) |
31.64361425 |
9.041032644 |
(Menden-Deuer ve Lessard, 2000) |
|
Diatoms |
63942.5* |
(Arin vd., 2002) |
1999.404422 |
571.2584063 (3.5 C:N used for convertion ) |
(Menden-Deuer ve Lessard, 2000) |
|
Dinoflagellate |
9404* |
(Arin vd., 2002) |
1365.03264 |
278.8318722 |
(Menden-Deuer & Lessard, 2000) |
|
Cryptophyte |
14* |
(Fanuko ve Valcıc, 2009) |
6.602050792 |
1.109334967 |
(Menden-Deuer ve Lessard, 2000) |
|
Dictyochale |
13309** |
(Fanuko ve Valcıc, 2009) |
1814.157979 |
374.4548551 |
(Menden-Deuer ve Lessard, 2000) |
* Arin vd., (2002) tarafından verilen örneklem istasyonları C2 ve C4 için ortalama değerler
** Dictyochale için verilen ortalama değerler
Bakteriyel popülasyonlara metagenomik yaklaşım
Örnekleme
Örnekler, 15 Eylül 2016 ve 14 Ağustos 2017 tarihleri arasında Erdemli Zaman Serisi'nin ETS-200 istasyonundan bir yıl süreyle aylık olarak toplanmıştır. CTD rozet sistemine bağlı niskin şişeleri kullanılarak örnekler yüzey, 25 m, 50 m, 100 m ,150 m ve 200 m derinliklerinden metagenomik çalışma için toplanmıştır. Niskin şişeleri ile toplanan deniz suyunun iki litresi her bir derinlikten borosilikat koyu bir şişeye örneklenmiş ve metagenomik çalışma için 0,22 um gözenek boyutlu filtreler (polieter sülfon membran-MoBio) üzerine süzülmüştür. Örnekler, daha sonra, ODTÜ- DBE'nin genetik laboratuvarında DNA izolasyonu için işlenmiştir. Hava koşulları nedeniyle Aralık 2016’da örnekleme yapılamamıştır. Her ay yapılan örnekleme tarihleri, derinlikleri ve yüzey ile 200m’ye ait sıcaklık ölçümleri Tablo 2'de özetlenmiştir.
Tablo 2. Örnekleme tarihleri ve yüzey ile 200m’ye ait deniz suyu sıcaklık verileri
|
Ay |
Tarih |
Derinlik (Metre) |
Yüzey/ 200m Su Sıcaklığı (C°) |
|
Eylül |
08/09/2016 |
0, 25,50,100,150, 200 |
29,5/16,7 |
|
Ekim |
20/10/2016 |
0, 25,50,100,150, 200 |
26,2/16,0 |
|
Kasım |
15/11/2016 |
0, 25,50,100,150, 200 |
- |
|
Ocak |
30/01/2017 |
0, 25,50,100,150, 200 |
17,6/17, 1 |
|
Şubat |
20/02/2017 |
0, 25,50,100,150, 200 |
17,1/16,1 |
|
Mart |
28/03/2017 |
0, 25,50,100,150, 200 |
17,9/16,9 |
|
Nisan |
17/04/2017 |
0, 25,50,100,150, 200 |
18,5/16,3 |
|
Mayıs |
25/05/2017 |
0, 25,50,100,150, 200 |
21,7/16,4 |
|
Haziran |
30/06/2017 |
0, 25,50,100, 200 |
28,3/16,2 |
|
Temmuz |
20/07/2017 |
0, 25,50,100,150, 200 |
29,6/16,5 |
|
Ağustos |
14/08/2017 |
0, 25,50,100,150, 200 |
30,0/16,1 |
DNA izolasyonu ve Sekanslama
DNA izolasyonu Paz vd., (2003) tarafından önerildiği şekilde yapılmıştır. Her bir numuneden alınan DNA miktarı, daha sonra spektrofotometri ile ölçülmüştür. Dizileme işlemi çift yönde Dr. Zeydanlı Hayat Bilimleri Ltd. Şti. tarafından yapılmıştır. Amplicon dizileme işlemi Illumina MiSeq platformunda (300bp paired-end dizileme) gerçekleştirilmiş ve en az 100,000 okuma/ 30Mb veri örnek başına elde edilmiştir. 16S rRNA geninin V3-V4 bölgesi, 341F ve 805R primer çiftleri kullanılarak amplifiye edilmiştir. (Herlemann vd., 2011). Dizileme kütüphanesi DNA örneğinin rastgele parçalanması, ardından 5 've 3' adaptör ligasyonu ile hazırlanmıştır. Scythe (v0.994) ve Sickle programları adaptör dizilerinin kesilmesi için kullanılmıştır. Adaptör dizileri kırpıldıktan sonra, 36bp'den daha kısa okumalar atılmıştır.
Biyoenformatik analizler
Analiz için Illumina kırpılmış çift uçlu okumalar (trimmed paired-end reads) kullanılmıştır. Diğer analiz basamakları için QIIME2 çerçevesi ve komut satırı arayüzü kullanılmıştır (https://qiime2.org), (Caporaso vd., 2010). Paired-end okumaların birleştirilmesi , kalite okuması ve primer filtrelemesi, chimera tanımlanması Divisive Amplicon Denoising Algorithm (DADA2) (Callahan vd., 2016) algoritması kullanılarak yapılmıştır. OTU/BIOM tablosuna eşdeğer olan özellik tablosu- Feature Tablo - ve temsili dizi dosyalarının eşdeğeri olan özellik verileri de aynı algoritma ile üretilmiştir.
Taksanomik sınıflandırma doğruluğu, önerildiği üzre (Werner vd., 2012), Naive Bayes classifier (https://github.com/qiime2/q2-sample-classifier) hedef bölgemize (V3-V4) göre eğitimi ile geliştirilmiştir. Taksanomik atamalar Silva veri bankası kullanılarak gerçekleştirilmiştir. Filogenetik ağaç oluşturmadan önce dizilerin hizalanması MAFFT (2017.12.0) (Katoh ve Standley, 2013) algoritmasını QIIME2 ara yüzü ile gerçekleştirilmiştir.
Filogenetik ağaç FastTree 2 (Price vd., 2010) ile yapılmıştır. Çeşitlilik ve istatistik analizler öncesinde Kloroplast olarak sınıflandırılan diziler veri setinden temizlenmiştir.
Çeşitlilik Ölçümleri hesaplama ve istatistiksel testler
Alfa ve beta çeşitlilik ölçümleri, verilen toplulukların ne kadar çeşitli olduğunu araştırmak için önemli araçlardır. Alfa çeşitliliği, örnek içindeki çeşitliliği bulunurken, beta çeşitliliği, belirli bir konumdaki örnekler arasındaki çeşitliliği karşılaştırmak için kullanılır. Mikrobiyal popülasyonların örneklem içi karmaşıklığını değerlendirmek için, Shannon'un çeşitlilik indeksi (topluluk zenginliğinin niceliksel bir ölçümü) ve özellikler arasında filogenetik ilişkileri içeren topluluk zenginliğinin niteliksel bir ölçümü olan Faith'in Filogenetik Çeşitliliği, QIIME 2 kullanılarak hesaplanmıştır.
16S rRNA örnekleri arasındaki çift yönlü topluluk benzerliği, filogenetik mesafe kullanılarak hesaplanan weighted UniFrac (Chang vd., 2011; Lozupone vd., 2011) yöntemi ile ve Bray-Curtis uzaklığı ile hesaplanmıştır..
Yaygın olarak kullanılan bir metot olarak veri setindeki varyansı açıklamak için Principle Coordinates Analysis (PCoA) kullanılmıştır. Temel olarak, ordinasyon boşluğuna nesneler arasındaki mesafenin veya farklılıkların doğrusal (Euclidean) haritalaması yapılır ve algoritma orijinal veri kümesindeki varyansın çoğunu açıklamaya çalışır (Paliy ve Shankar, 2016). PCoA, UniFrac mesafeleri ve Bray- Curtis mesafeleri gibi herhangi bir çeşitlilik ölçüsü ile kullanılabilir ve grafikler EMPeror kullanılarak oluşturulmuştur (Vázquez-Baeza vd., 2013).
PCoA, veri kümesinin özelliklerini keşfetmek için önemli bir araç olsa bile, bileşenler (sıcaklık gibi çevresel değişkenler) ve orijinal değişkenler (türlerin çeşitliliği veya beta çeşitliliği ölçütleri) arasında doğrudan bir bağlantı sağlamaz. Çevresel varyasyonlara türlerin cevabını araştırmak için tür cevabını açıklamak için unimodal model kullanan Canonical correspondence analysis (CCA) (Paliy ve Shankar, 2016; Ramette, 2007; Wang vd., 2012) kullanılmıştır. CCA analizi R vegan paketi kullanılarak yapılmıştır (Oksanen vd., 2007).
Doğası gereği ekolojik gözlemler, çok sayıda tür ve içsel değişkenliği içerir, dolayısıyla çok büyük miktarda gürültülü verilere bağlı olarak sonuçları yorumlamak zordur. Ancak, çok değişkenli yöntemler (multivariate methods), sistematik değişimi gürültüden ayırarak verileri yapılandırmak için bir araç sağlar (Braak ve Verdonschot, 1995). CCA, eksenlerin çevresel değişkenlerin doğrusal kombinasyonları olduğu unimodal tür-çevre ilişkisine dayanmaktadır. Bir diğer avantaj, CCA'nın, mutlak bolluk değerlerinden ziyade, dizileme çalışmalarının çıktısı olan (tür puanları, örnekteki puanların ağırlıklı ortalamalarıdır) rölatif bollukları kullanmasıdır. Ki-kare mesafelere dayanır ve ağırlıklı doğrusal haritalama yapar. CCA, öncelikle, koordinasyon eksenleri tarafından oluşturulan bir koordinat sistemi ile sonuçlanır ve türler (OTB'ler), sahalar (örnekleme birimleri) ve niteliksel çevresel değişkenler (örnekleme mevsimi gibi) sınıfları ve kantitatif çevresel değişkenleri (sıcaklık gibi) temsil eden oklar gibi unsurları içerir. Açıklanan inertia ile temsil edilen toplam inertia oranı (inertia, CCA'daki verilerin açıklanmış varyasyon ölçüsüdür) bir R2 olarak yorumlanabilir. Analizden önce, tüm örneklerin %20'sinden fazlasında gözlenmeyen dizi varyantları analizden çıkarılmıştır.
Biyojeokimyasal döngülerde önemli rol oynayan bakteriyel popülasyonların metatranscriptomik incelenmesi
Örnekleme ve Toplam RNA izolasyonu
Metatranscriptom çalışması için gereken toplam RNA örneklerinin mevsimsel olarak toplanması hedeflenmiştir. Ayrıca 4 farklı derinlikten örnekleme yapılıp (0, 25, 150 ve 200 metre) her mevsimden bir örneğin dizilenmesi planlanmıştır. Örneklemeler diğer örneklemelerle paralel olarak 15 Kasım 2016, 20 Şubat 2017, 30 Haziran 2017 ve 04 Temmuz 2017 tarihinde gerçekleştirilmiştir (Tablo 3). Metagenomik çalışması için su örnekleri ile aynı Niskin şişesinden alınan 2 litrelik örnekler ivedilikle carnoy fiksatifi (Feike vd., 2012) ile sabitlenmiştir. Deniz suyu örnekleri laboratuvarda 0,2 μm göz açıklıklı filtreden süzülmüş ve filtreler -20°C’de saklanmıştır. Tüm sezonlara ait örneklemeler tamamlandıktan sonra toplam RNA izolasyonu, EZ-RNA Total RNA Isolation Kit (Biological Industries) kullanılarak tamamlanmıştır. Toplam RNA’dan mRNA saflaştırma işlemi, kütüphane oluşturma ve dizileme işlemi için örnekler Dr. Zeydanlı Hayat Bilimleri Ltd. Şti.’ye gönderilmiştir.
Tablo 3. Örneklerin filtre üzerine süzülebilen miktarları
|
Örnek |
Tarih |
Derinlik |
Süzülen miktar (ml) |
|
R1 |
15.11.2016 |
0 |
1000 |
|
R2 |
15.11.2016 |
50 |
1000 |
|
R3 |
15.11.2016 |
150 |
1500 |
|
R4 |
15.11.2016 |
200 |
1200 |
|
R5 |
20.02.2017 |
0 |
2000 |
|
R6 |
20.02.2017 |
50 |
1700 |
|
R7 |
20.02.2017 |
150 |
1000 |
|
R8 |
20.02.2017 |
200 |
1000 |
|
R9 |
30.06.2017 |
0 |
2000 |
|
R10 |
30.06.2017 |
50 |
2000 |
|
R11 |
30.06.2017 |
150 |
2000 |
|
R12 |
30.06.2017 |
200 |
2000 |
|
R13 |
04.07.2017 |
0 |
2000 |
|
R14 |
04.07.2017 |
50 |
2000 |
|
R15 |
04.07.2017 |
150 |
2000 |
|
R16 |
04.07.2017 |
200 |
2000 |
Dizileme ve Veri İstatistikleri
Ribozom deplition basamağını da içeren Trueseq stranded total RNA kit (with ribosomal depletion (microbe)) kütüphane çalışmasında kullanılmıştır. Kütüphane oluşturma işlemi öncesinde örneklerin kalite kontrolleri sırasında RIN (RNA entegrasyon sayısı) değerleri ve RNA miktarları oldukça düşük çıkmıştır (Tablo 4). Bunlar göz önünde bulundurularak aynı aya ait farklı derinlikten olan örneklerin birleştirilmesine karar verilmiştir. Böylece, dizileme işlemi dört örnekte gerçekleştirilmiş ve su kolonu entegre sonuçları yansıtmaktadır. Dizileme platformu olarak Illumina MiSeq platformunu (100bp paired-end - çift yönlü- dizileme) gerçekleştirilmiştir.
Tablo 4. RNA örnekleri kalite ve miktar değerleri
|
Örnek |
Konsantrasyon (ng/ul) |
Son Hacim (ul) |
Toplam Miktar (ug) |
RIN |
|
|
R1 |
1,052 |
63 |
0,066 |
1 |
|
|
R2 |
1,367 |
30 |
0,041 |
1,9 |
|
|
R3 |
1,406 |
30 |
0,042 |
3,5 |
|
|
R4 |
1,633 |
30 |
0,049 |
1 |
|
|
R5 |
5,316 |
30 |
0,159 |
3,5 |
|
|
R6 |
3,856 |
30 |
0,116 |
4,3 |
|
|
R7 |
1,135 |
65 |
0,074 |
2,5 |
|
|
R8 |
0,831 |
65 |
0,054 |
3,2 |
|
|
R9 |
1,771 |
65 |
0,115 |
2,7 |
|
|
R10 |
2,175 |
65 |
0,141 |
1,1 |
|
|
R11 |
1,522 |
65 |
0,099 |
1 |
|
|
R12 |
0,975 |
65 |
0,063 |
1 |
|
|
R13 |
2,518 |
63 |
0,159 |
4,2 |
|
|
R14 |
2,44 |
30 |
0,073 |
4,6 |
|
|
R15 |
1,854 |
28 |
0,052 |
3,8 |
|
|
R16 |
0,848 |
30 |
0,025 |
1 |
|
Biyoenformatik analizler
Elde edilen okumalar online metatranskriptom veri analiz programı olan COMAN (a web server for comprehensive metatranscriptomics analysis) kullanılarak yapılmıştır. Program verileri otomatik ve kapsamlı bir şekilde analiz etmek için geliştirilmiştir (Ni vd., 2016). COMAN analiz hattı, ham okumaların kalite kontrolünü, kodlamayan RNA'dan türetilen okumaların analizden çıkarılmasını, ardından fonksiyonel ek açıklamaları içerir. Referans genomlara ait okumaların ve fonksiyonel açıklama sonuçlarının haritalanmasına dayanarak, COMAN işlevsel profilleme atamaları gerçekleştirir ve her bir fonksiyonel grup ve enzimin göreceli bolluğunu ve ayrıca annotation sistemindeki daha yüksek bir hiyerarşi seviyesini hesaplar. Bu yüksek seviyeli profil, COG kategorileri, KEGG yolları, KEGG yolu sınıfları, KEGG modülleri ve çeşitli MetaCyc yolları seviyelerini içerir (Ni vd., 2016). COMAN sunucusundan elde edilen KEGG yolu sonuç dosyasında azot, fosfat döngülerinde incelenecek hedef genler ve xenobiotik aktivitesi genleri KEGG numaralarına göre yazılan kod kullanılarak dosyadan çekilmiştir. Mikrobiyal plastik degredasyonunda rol oynadığı belirlenen genler (Bryant vd., 2016; Quero ve Luna, 2017)’dan alınmıştır.
Bakterilerin fonksiyonel gruplarının belirlenmesi
PICRUSt, marker gen (ör., 16S rRNA) kullanılarak yapılan çalışmalardan fonksiyonel içeriği tahmin etmek için tasarlanmış bir biyoenformatik yazılım paketidir (Caporaso vd., 2013). Bu yazılım kullanılarak, 16S rRNA dizi sonuçlarından fonksiyonel atamaları yapılmıştır. Daha sonra, yüzde bolluk cinsinden verilen azot döngüsü marker genleri elde edilen sonuç dosyasından ayıklanmış ve heterotrofik bakteri hücre bolluk sayımları kullanılarak gerçek değerlere çevrilmiştir.
Bakteriyel reaksiyon hızlarının izotop yöntemiyle tayin edilmesi
İki farklı mikrobiyal sürecin hızları izotopik izleyiciler kullanılarak belirlenmiştir. İki izotopik deney yapılmıştır: azot fiksasyonu ve nitrifikasyon. Yeni nitrojenin biyolojik yollarla deniz ekosistemine girişlerini değerlendirmek için foto-ototrof bakterileri tarafından gerçekleştirilen azot fiksasyonunun hızları ölçülmüştür. Eş zamanlı olarak, nitrifikasyon hızları, NH4+ 'nın kullanılması ve NO3-'ün deniz suyuna salıverilmesinde rol oynayan kemo-ototrof bakterilerinin önemini tahmin etmek için ölçüldü.
Her iki süreçte elde edilen sonuçlar, kurulan modelin mikrobiyal reaksiyon hızlarının gerçekçi bir şekilde yeniden üretilmesi yeteneğini doğrulamak için kullanılmıştır.
İzotop Deneyleri: Azot fiksasyonu
N2-fiksasyon hızları 15N2 asimilasyon izleyici metodu ile belirlenmiştir. N2 -fiksasyonu 15N2 ' nin organik N'ye biyolojik dönüşümünün doğrudan ölçümünü temel alınarak yapılmıştır. (Montoya vd., 1996; Montoya vd., 2004).
Örnekleme Ocak-Aralık 2017 tarihleri arasında Erdemli Zaman Serileri (ETS-200) istasyonunda aylık olarak tekrarlanmıştır. N2-fiksasyonu oranlarının ölçümü, 15N2 gaz uygulayıcı aparatın kaybı nedeniyle Mayıs ve Haziran aylarında yapılamamıştır. Yurtdışından ithal edilen 15N2 gaz izleyicinin değiştirilmesi, 2 ay sürmüştür. İlkbahar sonlarında daha iyi bir temsile sahip olmak için, temmuz ayında, numuneler ayın başında ve sonunda toplanmıştır. Deniz suyu dört derinlikten, ikisi ışıklı tabakadan (yüzey ve %1 ışık derinliğinden, genellikle 100m derinlikten) ve diğer iki örnek ise afotik tabakadan (150m ve 200m) toplanmıştır. Tüm derinliklerde, gaz değişimini önlemek için serum kaplamalı polikarbonat 4.6 litre Nalgene şişeleri kullanılarak dört örnek toplanmıştır. Üç tekrarlı örnek, gaz geçirmez bir şırınga ile 9.2 ml (2 ml / L) 15N2 (Cambridge Isotope Laboratories Inc.,% 98.00 atom%) gazı ile zenginleştirilmiştir. Bir örnek (kontrol) ise 15N2 gazı eklenmeden inkübe edilmiştir. Gaz enjeksiyondan önce, her şişe dikkatlice kontrol edilmiş ve hava kabarcıkları doğru şekilde çıkarılmıştır. Gaz ilave edildikten sonra, tüm numuneler (zenginleştirilmiş ve kontrol örnekleri), 15N2 gazının deniz suyunda çözünmesi için manyetik karıştırıcı üzerinde 30 dakika süreyle yavaşça karıştırılmıştır. Numuneler laboratuarda 24s boyunca inkübe edilmiştir. In situ ışık ve sıcaklık koşulları termostatlı inkübatörler ve nötr yoğunluk filtreleri kullanılarak sağlanmıştır.
İnkübasyondan sonra, hem kontrol hem de 15N2 zenginleştirilmiş örnekler önceden yakılmış (450 °C, 6 saat) GF/F filtrelere süzülmüştür. Filtreler daha sonra paketleme için -20 ° C'de donduruldu. Örnekleme işleminin sonunda, tüm dondurulmuş filtreler 24 saat boyunca 60 ° C'de kurutuldu, tin-foil kaplarda topaklandırıldı ve kütle spektrometri analizine kadar kuru bir ortamda saklandı. Kontaminasyondan kaçınmak için kontrol ve zenginleştirilmiş örnekler her zaman ayrı ayrı işlemden geçirilmiştir. Fitoplanktonların ışıktan göreceği hasarı önlemek için deneylerin her adımı loş ışık koşullarında gerçekleştirilmiştir.
N2- fiksasyonu örneklerindeki partikül organik ve azot kütle fraksiyonları peletlerdeki δ15 N(POA) kütle fraksiyonları sürekli akış izotop oranı kütle spektrometresi (EA1112-Delta Plus, Thermo Fisher Scientific) ile birleştirilen bir element analiz cihazı ile ölçülmüştür. Örneklerin δ15N (POA) değerleri IAEA-N-1'e göre kalibre edilmiştir. Hassasiyet, örneklerle birlikte laboratuvar standartlarının (Amino Standard, SI Science) ölçülmesinden hesaplanmıştır. Örnekler, Norwich Araştırma Parkı, Doğu Anglia Üniversitesi (Norwich, İngiltere), Kararlı İzotop Tesisi’nde (Stable Isotope Facility) analiz edilmiştir. Partikül Organik Azot içindeki 15N'nin zenginleştirilmesi kontrol numuneleri ile karşılaştırılarak yapılmıştır. 15N ölçümünün ortalama hassasiyeti (tüm tekrarlı örneklerin ortalaması) ± %0.0001 (± 0.3 ‰)’dir. Bu nedenle, standart sapmanın iki katını (>% 0.0002 atomu) aşan 15N zenginleşmesi ile hesaplanan QN2 verisi anlamlı bulunmuştur.
Nitrifikasyon
Nitrifikasyon hızları, NH4+substratının izotopik bir etiketle değiştirilmesi ve 24 saat sonra üretilen NO3'te izotop izleyicinin artışının ölçülmesiyle belirlenmiştir. 15NO3- konsantrasyonunun artışı, nitrojen bakterilere bağlı olarak NH4+ve NO2- 'den (iki aşamalı reaksiyon) elde edilen NO3- ‘ün doğal üretiminden kaynaklanır (Rasigraf vd., 2017).
Ocak ayından Aralık 2017'ye kadar Erdemli Zaman Serileri (ETS-200) istasyonunda her ay örnekleme tekrarlanmıştır. Şubat ayında lojistik problemler nedeniyle numuneler toplanamamıştır. Temmuz ayında, numuneler ayın başında ve sonunda iki kez toplanmıştır. Örnekleme dört derinlikte (N2 fiksasyon çalışması ile aynı), ikisi ışıklı/fotik (yüzey ve %1 ışık, genellikle 100m derinliğe tekabül eder) ve iki tanesi afotik tabakada (150 ve 200m) gerçekleştirilmiştir. Tüm derinliklerden 2L siyah HDPE Nalgene şişesi kullanılarak dört örnek toplanmıştır. Üç replikat, otomatik pipetle (orijinal konsantrasyonun yaklaşık % 30-50'si), litre başına 700 ng 15NH4+ (Cambridge Isotope Laboratories Inc.,% 98.00 atomu) ile zenginleştirilmiştir. Bir replikat (kontrol) 15NH4+eklenmeden inkübe edilmiştir. İzleyici ilavesinden sonra, tüm numuneler (zenginleştirilmiş ve kontroller) 3 dakika boyunca kuvvetlice karıştırılmıştır. Numuneler laboratuarda 24s boyunca inkübe edilmiş ve In situ ışık ve sıcaklık koşulları termostatlı inkübatörler ve nötr yoğunluk filtreleri kullanılarak sağlanmıştır. İnkibasyondan sonra, numuneler tüm organizmaları uzaklaştırmak ve numuneyi steril tutmak için 0.2 um açıklıklı filtrelerden süzülmüştür. Her numuneden 50 ml'lik iki alt örnekleme yapıldı ve nihai analize kadar -20 ° C'de saklandı. Örnekleme periyodunun sonunda tüm numuneler, azotun izotopik oranının kütle spektrometresi ile belirlenmesi için East Anglia Üniversitesi (Norwich, İngiltere), Norwich Araştırma Parkı'na gönderilmiştir. Nitrifikasyon oranları, izleyicinin (15NH4+ Cambridge İzotop Laboratuarları) eklenmesinden sonraki 24 saat içinde NO3'teki 15/14 N'nin analiz edilmesiyle hesaplanır. “Denitrifikat yöntemi” (“denitrifier method) (Sigman vd., 2001) kullanılarak NO2 ve N NO3-'den üretilen N2O'nun δ15N değeri Popp ve ark. (1995) ve Dore ve diğ. (1998) tarafından tanımlanan yöntem kullanılarak ölçülmüştür (Dore vd., 1998; Popp vd., 1995). Özellikle, bu yöntem, N2O-redüktaz aktivitesi olmayan denitrifikasyon bakterilerinin (Pseudomonas chlororaphis ve Pseudomonas aureofaciens) nitrattan üretilen azot oksidin (N2O) izotopik analizine dayanmaktadır. N20 içinde bulunan hem nitrojen hem de oksijeninin izotopik bileşimine (nitratın izotopik imzasını yansıtır), bu şekilde izotop oranı kütle spektrometresi ile erişilebilir.
Nitrifikasyon hızı analizi yapılan örneklerde, NO3- ‘te bulunan δ15N, IAEA-NO-3'e karşı kalibre edilmiş analit gazı olarak N20 kullanan denitrifikat yöntemi ile belirlenmiştir (Casciotti vd., 2002). Uluslararası referans materyali olan USGS34, USGS35, IAEA-NO-3, delta değerlerinin kalibrasyonunda δ(15N) = 4,7 ‰ (vs. air-N2) kullanılmıştır. Tekrarlanabilirlik, yinelenen analizlerin ortalama standart sapmasından elde edilen 0,08 ‰ ‘dir. İzotopik ayrıştırma, sürekli akış izotop oranlı kütle spektrometresi (EA1112-Delta Plus, Thermo Fisher Scientific) ile birleştirilen bir element analiz cihazı ile ölçülmüştür.
Mikroorganizmalar tarafından yürütülen reaksiyon hızlarının ölçümler ve ters modelleme yaklaşımıyla belirlenmesi
Projenin bir diğer amacı ETS 200m istasyonundaki fizikler, kimyasal ve biyolojik dinamikleri temsil eden bir modelleme sistemi geliştirmek ve bu sistemin bakteriyel reaksiyon hızlarını tahmin edebilme yetisini ölçmektir.
Bu amacı yerine getirmek için bir fiziksel model (General Ocean Turbulence Model - GOTM) ve bir biyojeokimyasal model (The European Regional Seas Ecosystem Model - ERSEM) biraya getirilerek bu projedeki bilimsel soruları cevaplayacak bir modelleme sistemi geliştirilmiştir. Burada geliştirilen model sistemi hem su kolonunun fiziksel dinamiklerini çözebilmekte, hem de biyolojik ve kimyasal öğelerdeki anlık değişim hızlarını hesaplayabilmektedir. Genel amaçlı yayınlanmış olan GOTM ve ERSEM modelleri, bu proje kapsamında Doğu Akdeniz’e temsil edecek şekilde uyarlanmış, bazı model kompartımanları çıkartılmış, bazıları ise değiştirilmiştir.
Modelleme sistemi birbiri ile bağlantılı ve aynı anda çalışan biyojeokimyasal modelin fonksiyonu biyolojik ve kimyasal öğelerdeki anlık değişim hızlarını hesaplamak, fiziksel modelin fonksiyonu ise öğelerin su kolonu boyunca mekânsal dağılımlarını ve zaman içindeki değişimlerini çözmektir.
Uyarlanan bu bütünleşik (integrated) model, modelin öğeleri arasındaki madde ve enerji akışını belirleyen onlarca parametre içermektedir. Denizel biyojeokimya modellerinin başarısını sınırlayan en önemli faktörlerden biri bu parametrelerdeki belirsizliktir. Bu açıdan diğer iş paketleri ve ETS kapsamında yapılan yüksek zamansal çözünürlüklü ve birçok veri türünü içeren veri seti, modelin kalibre edilmesi (parametre tahmini) için önemli bir fırsat sağlamaktadır. Parametre tahmini, model tahminleri ile saha ölçümlerini karşılaştırarak ve bu ikisi arasındaki farkı parametreleri iteratif bir şekilde değiştirerek minimize etmekle görevli bir algoritma aracılığıyla yapılmıştır.
Parametre tahmini bittikten sonra, ölçümlerle model tahminleri arasındaki farkı minimize eden parametre değerleri kullanılarak model tekrar çalıştırılmıştır. Kalibre edilmiş bu modelin tahmin ettiği bakteriyel reaksiyon hızları, izotop yöntemiyle ölçülen hızlarla karşılaştırılarak modelin bu reaksiyonları ölçme yetisi sınanmıştır. İzotop analiz sonuçları model kalibrasyonunda kullanılmamaları nedeniyle modelin tahmin başarısını ölçmeye yarayacak bağımsız bir veri seti teşkil etmektedirler.
Son olarak model 10 yıllık bir süre için çalıştırılmış ve bu proje’den önce yapılmış ölçümleri tahmin yeteneği sınanmıştır.
Projede kullanılan model ve yöntemlerin detayları aşağıda alt iş paketler kapsamında verilmiştir.
Fiziksel modelin ETS istasyonuna uyarlanması ve çalıştırılması
Su kolonun sıcaklık, tuzluluk ve yoğunluk gibi fiziksel özelliklerini tahmin eden ve su kolonunda yer alan kimyasal ve biyolojik öğelerin dikey taşınımını sağlayan fiziksel modeldir. Bu projede fiziksel su kolonu modeli olarak General Ocean Turbulence Model (GOTM) kullanılmıştır (Umlauf vd., 2012). GOTM tüm dünyada birçok denize uyarlanmış (örneğin Burchard vd., 2002; Carniel vd., 2007; Yakushev vd., 2011) açık kaynaklı ve tek boyutlu (dikey boyut) bir modeldir. Doğal sularda dikey karışım ile ilgili en önemli hidrodinamik ve termodinamik süreçleri içermektedir. Ek olarak, üç boyutlu dolaşım modellerine kolayca bağlanabilecek ve dikey türbülanslı karışımın hesaplanması için bir modül olarak kullanılabilecek şekilde tasarlanmıştır. Modelin çekirdeği, momentum, tuz ve ısı taşınım denklemlerinin tek boyutlu versiyonları için çözümler hesaplar. Bu denklemlerin çözümünde önemli bir bileşen, bu miktarların türbülanslı akılarının modelidir ve GOTM bu konuda birçok alternatif algoritma içermektedir.
Su kolonunun fiziksel özelliklerinin değişimi atmosferdeki değişimlerle doğrudan bağlantılıdır ve GOTM, deniz-hava arayüzündeki bazı atmosferik değerlere sınır koşulu olarak ihtiyaç duymaktadır. Model için gerekli olan atmosferik girdiler rüzgâr hızı, hava basıncı, hava sıcaklığı, özgül nem, bulutluluk ve yağmur miktarıdır. Model bu atmosfer verilerini kullanarak denize giren ve denizden çıkan ısı miktarını ve ışınımı, buharlaşma ve yağmur kaynaklı tuzluluk değişimini ve rüzgâr kaynaklı türbülanslı karışım miktarını belirler.
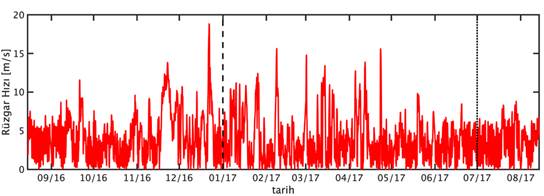
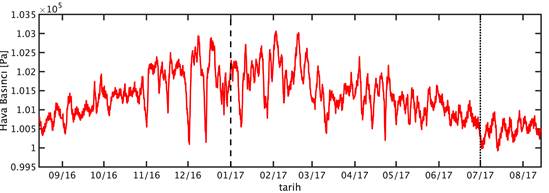
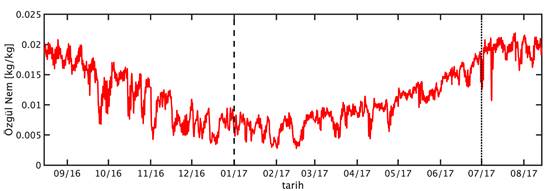
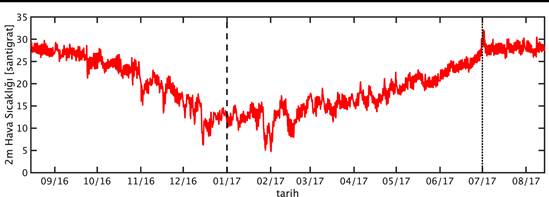
GOTM için gereken atmosfer verileri European Centre for Medium-Range Weather Forecasts (ECMWF) tarafından sağlanan ERA-Interim veri bankası’dan (Dee vd., 2011) 3 saat zaman çözünürlükte ve tüm Doğu Akdeniz’i kapsayacak şekilde indirilmiştir. İndirilen bu veri setinden ETS 200m istasyonunu kapsayan ızgara karesi örnekleme süresini kapsayacak şekilde izole edilmiştir. Bu verilerin örnekleme süresi boyunca zamansal değişimleri Şekil 4’de verilmiştir. Bu veri seti atmosferik ölçüm verilerinin asimile edildiği bir atmosfer modeli simülasyonunun çıktısıdır.
|
A) |
|
|
B) |
|
|
C) |
|
|
D) |
|
|
E) |
|
|
|
|
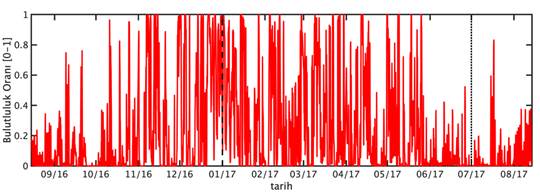
Şekil 4: Örnekleme noktasında ve örnekleme zaman dilimi boyunca (A) rüzgar hızı, (B) hava basıncı, (C) özgül nem, (D) hava sıcaklığı ve (E) bulutluluk oranı.
Model sayısal yapısı dolayısıyla fiziksel değerleri tüm su kolonu boyunca değil, kullanıcının belirlediği derinliklerdeki sınırlı sayıda ızgara noktasında (grid point) çözmektedir. Bu kapsamda yüzeye yaklaştıkça sıklıkları artan ve toplam sayıları 50 olan ızgara derinlikleri seçilmiştir. Bu stratejinin amacı karışmış tabakada yüksek sayısal doğruluk elde etmektir.
Model sıcaklık ve tuzluluk başlangıç koşulları 15 Ağustos 2016 tarihli ETS seferinde yapılan CTD ölçümlerinden elde edilmiştir. Bu veriler ölçüm yapılan derinliklerden model ızgara derinliklerine doğrusal enterpolasyon yoluyla uyarlanmıştır. Model simülasyonunun bitiş tarihi bir yıllık örnekleme döneminin sonuna denk gelen 14 Ağustos 2017’dir.
Her ne kadar su kolonunun fiziksel özellikleri GOTM tarafından çözülse de bu özelliklerin örnekleme sırasında yerinde ölçüldükleri unutulmamalıdır. GOTM’un bu özellikleri ölçümler kadar doğru tahmin edebilme imkanı yoktur. Tahminleri gerçek değerlere mümkün olduğu kadar yaklaştırmak amacı ile model tahminleri ölçümlere doğru itilmiştir. Kullanılan yöntemin ismine sayısal rahatlatma (relaxation) ismi verilmektedir ve GOTM’da bunu mümkün kılan özellik bulunmaktadır. Rahatlama zamanı hem tahminlerin gerçek değerlerden çok uzaklaşmamasını sağlayan hem de modelin iç dinamiklerinin açığa çıkmasını engellemeyen bir zaman olan 30 gün olarak seçilmiştir. Bu da yaklaşık olarak örnekleme aralığına denk gelmektedir. Bu yöntemle fiziksel model verilerin arasındaki zamansal boşluğu dolduran ve örnekleme sırasında ölçülmeyen değerleri (ör. karışım) tahmin eden bir araç olarak kullanılmaktadır.
Rahatlama yöntemi aynı zamanda modelin tek boyutlu olmasından kaynaklanan bir sorunu da çözmektedir. Doğu Akdeniz net su bütçesi eksi değerde olan bir su kütlesine sahiptir ve Atlantik kaynaklı suyun eksikliği durumunda deniz tuzluluğu artma eğilimi gösterecektir. Yatay boyutu içeren bu sürecin eksikliği model tuzluluk tahminlerinde aynı etkiyi yaratmaktadır, ancak rahatlama yöntemi ile bu etki minimize edilebilir.
Biyojeokimyasal modelin geliştirilmesi ve uygulanması
Biyojeokimyasal model karbon, azot, fosfor ve silikon gibi biyojeokimyasal süreçlerde önemli roller oynayan elementlerin organik ve inorganik formları arasındaki akışını hesaplayan sayısal bir araçtır. Bu modelin görevi bu akışların anlık hızlarını hesaplayıp fiziksel modele aktarmaktır. Fiziksel model ise bu hızları kullanarak hem biyojeokimyasal model öğelerinin dikey taşınımını gerçekleştirir, hem de bu öğelerin zamansal entegrasyonunu sağlar. Biyojeokimyasal model ise anlık akış hızlarını hesaplarken fiziksel modelden gelen su sıcaklığını ve güneş ışınımını kullanır. Birçok biyolojik ve kimyasal reaksiyonun hızı su sıcaklığına bağlıdır ve fitoplanktonların büyüme hızı güneş ışınımına bağlıdır, dolayısıyla biyojeokimyasal modelin bu fiziksel değerleri fiziksel modelden sağlamakla yükümlüdür.
Proje kapsamında geliştirilen modelleme sisteminde maddenin organik ve inorganik formları arasındaki akışın hesaplanması için ERSEM biyojeokimyasal modeli (Butenschön vd., 2016) uyarlanmış ve fiziksel model ile bağlantısı FABM (Bruggeman ve Bolding, 2014) ara yüzü kullanılarak yapılmıştır. ERSEM-FABM çerçevesi olduğu gibi bir bölgeye uygulanabilecek bir model değil, modeli oluştururken kullanılması istenilen bileşen ve süreçler için alternatif modüller sunan bir araç çantasıdır. Modelin kullanılması uygulanacak bölgeye has bileşen ve süreçlerin bilinmesi, bu bileşen ve süreçlerde bölge için ERSEM’in sunduğu alternatiflerden uygun olanlarının seçilmesi ve bu alternatiflerin uygunsuzluğu durumunda model kodunda değişiklik yapılmasını içermektedir. ERSEM-FABM çerçevesinin sunduğu bir başka avantaj ise birçok fiziksel model ile bağlantı sağlayabilmesidir. Fiziksel modeller ile biyojeokimyasal modeller arasında bilgi akışı sağlayan ara yüzler son on yılda modüler modellemenin popüler olmasıyla ve geliştirilmelerindeki zorluklardan dolayı birçok projenin konusu olmuşlardır (Bruggeman ve Bolding, 2014; Lemmen vd., 2018). Bu model çerçevesinin seçilmesinin diğer nedenleri arasında içerdiği süreçlerin detaylı ve gerçekçi olması, birçok denize uyarlanıp kullanılmış olması (Petihakis vd., 2006) gelmektedir. Bununla birlikte Avrupa denizleri için geliştirilmiş olması nedeniyle ileride Avrupa Birliği çerçeve programları kapsamında gerçekleştirilecek projelerde büyük olasılıkla bu model kullanılacaktır. Bu kapsamda bu proje model sisteminde ERSEM’in uyarlanması ileride avantaj olacaktır.
Model diatomlar, mikrofitoplankton, nanofitaplankton ve picofitoplankton olmak üzere dört fitoplankton bileşeni içermektedir. Bu bileşenler tür bazında değil, ekosistem içindeki fonksiyonları düşünülerek ayrılmıştır. Tüm fitoplankton bileşenlerinin ışığa, amonyak, nitrat, fosfat ve silikatı içeren inorganik besinlere bağlı olarak büyüme hızları değişmektedir. Bunun yanı sıra büyüme hızları su sıcaklığına da bağlıdır. Tüm fitoplankton türleri zooplankton türleri tarafından avlanılabilir. Ayrıca tüm fitoplankton türlerinin içerdikleri karbon, azot ve fosfat miktarı ayrı ayrı çözülmektedir ve böylece model değişken stokiometrileri temsil etme yetisine sahiptir. Yine tüm fitoplankton türleri değişken bir klorofil konsantrasyonuna sahiptir ve bu da model tarafından çözülmektedir. Diatom türleri diğer türlerin aksine Silikon bileşenine ve ayrıca çökme özelliğine sahiptir. Fitoplankton türleri öldüklerinde Partikül Organik Madde ’ye ve Çözünmüş Organik Madde ’ye dönüşür. Modelin fitoplankton bileşenleri bu süreçlerin hızlarını belirleyen, her türde var olan ancak türe göre kendine özgü değerler alan bir parametre setine sahiptir.
ERSEM mezozooplankton, microzooplankton ve heterotrofik dinoflagellatlar olmak üzere üç zooplankton türünü temsil etmektedir. Mezozooplankton tüm zooplankton ve fitoplankton türleri, bakteri ve orta boy partikül organik madde ile beslenmektedir. Microzooplankton yine tüm fitoplankton türleri, microzooplankton, heterotrofik dinoflagellatlar ve bakteri ile beslenmektedir. Heterotrofik dinoflagellatların ise nanofitaplankton, picofitoplankton, heterotrofik bakteri ve kendi türü olan heterotrofik dinoflagellatlar ile beslenmeleri mümkündür. Zooplankton türleri fitoplankton türleri gibi öldüklerinde Partikül Organik Madde’ye ve Çözünmüş Organik Madde’ye dönüşür. Tüm zooplankton türleri avlanma sonucu kazandıkları organik maddenin bir kısmını randımansız beslenmeden dolayı çevreye Çözünmüş Organik Madde olarak salmaktadırlar.
Model biyolojik canlılar dışında iki organik madde grubu içermektedir. Bunlardan biri Çözünmüş Organik Madde’dir ve üç alt türü bulunmaktadır: değişken, yarı değişken ve refrakter çözünmüş organik madde. Bunlardan sadece değişken olanı azot ve fosfor bileşenleri içerir ancak tüm türler karbon içermektedir. Çözünmüş Organik Madde organizmaların ölümü, randımansız beslenme, salgılama ve Partikül Organik Madde’nin çözünmüş hale dönüşümü aracılığıyla artar. Azalmasını sağlayan süreç ise bakteriler tarafından tüketilmeleri ve içindeki elementlerin mineralize edilmesidir. Partikül Organik Madde ise küçük, orta ve büyük boy olarak üçe ayrılmıştır ve bu alt türlerin çökme hızı büyüklüğe göre değişmektedir. Tüm alt türler karbon, fosfor ve azot içerir ancak sadece orta ve büyük boy partikül organik madde silikon içermektedir. Partikül Organik Madde organizmaların ölümü ve salgılama yoluyla ortaya çıkmakta ve çürüme ile Çözünmüş Organik Madde’ye dönüştürülmektedir.
ERSEM’de heterotrofik bakteri türü önemli roller oynamaktadır ve karbon, azot ve fosfor içeriği model tarafından çözülür. Bakterinin görevi Çözünmüş Organik Madde’yi ve Partikül Organik Madde’yi besin olarak kullanarak çoğalmak ve bu süreçte fitoplankton türleri için besin olan amonyak ve fosfat üretmektir (remineralizasyon). Bakteri organik maddede bulunan azot ve fosforun azlığı durumunda amonyak ve fosfat üretmek yerine bu maddeleri çevreden kullanabilir. Bakteri heterotrofik dinoflagellatlar tarafından besin olarak kullanılabilir ve ölü bakteriler diğer biyolojik öğeler gibi Partikül Organik Madde’ye ve Çözünmüş Organik Madde’ye dönüşür. Modelde amonyakın oksitlenerek nitrata dönüştürülmesi nitrifikasyon modülü tarafından gerçekleştirilmektedir.
Modelde oksijen fitoplankton tarafından üretilmektir ve aynı zamanda hava-deniz arasındaki oksijen akışı temsil edilmiştir. Denizde oksijeni tüketen süreçler arasında fitoplankton, zooplankton ve bakteriler tarafından solunumda kullanılması ve amonyakın oksitlenerek nitrata dönüştürülme (nitrifikasyon) bulunmaktadır. Modelin karbon sistemi, demire bağlı süreçler ve bentik ekosistem modülleri bu ögelerle alakalı veri eksikliğinden dolayı çalıştırılmamıştır.
Daha önce de belirtildiği gibi biyojeokimyasal model, model öğeleri arasındaki madde (karbon, azot, fosfat vb.) akış hızlarını kontrol eden onlarca parametre içermektedir. Fitoplankton türlerinin ışık ve inorganik besilerin miktarlarına göre büyüme hızlarını belirleyen parametreler, zooplankton türlerinin hangi türü ve ne hızla tükettiğini belirleyen parametreler ve bakterinin değişik organik madde türlerini ne hızla tükettiğini kontrol eden parametreler biyojeokimyasal modelin içerdiği parametrelere örnek teşkil etmektedirler. Bu parametrelerin değerleri daha önce Doğu Akdeniz için ERSEM modeli kullanılan bir çalışmadan alınmıştır (Petihakis vd., 2006). Bu parametreler, daha sonra parametre tahmin sisteminde başlangıç parametreleri olarak kullanılmıştır.
Tablo 5. Modelin tahmin ettiği bilinmeyenler (Model Öğeleri), modelde bunlar için kullanılan semboller ve içerdikleri elementler.
|
Model Öğesi |
Sembol |
İçerdiği Elementler/Moleküller |
|
Diatomlar (20–200 µm) |
P1 |
C, N, P, Si, Chl |
|
Nanofitoplankton (2–20 µm) |
P2 |
C, N, P, Chl |
|
Pikofitoplankton (0,2–2 µm) |
P3 |
C, N, P, Chl |
|
Mikrofitoplankton (20–200 µm) |
P4 |
C, N, P, Chl |
|
Pelajik Bakteri |
B1 |
C, N, P |
|
Heterotrofik nanoflagellatlar (2–20 µm) |
Z6 |
C, N, P |
|
Mikrozooplankton (20–200 µm) |
Z5 |
C, N, P |
|
Mezozooplankton |
Z4 |
C, N, P |
|
Çözünmüş Organik Madde (değişken) |
R1 |
C, N, P |
|
Çözünmüş Organik Madde (yarı değişken) |
R2 |
C |
|
Çözünmüş Organik Madde (yarı refraktar) |
R3 |
C |
|
Partikül Organik Madde (küçük) |
R4 |
C, N, P |
|
Partikül Organik Madde (orta) |
R6 |
C, N, P, Si |
|
Partikül Organik Madde (büyük) |
R8 |
C, N, P, Si |
|
Nitrat |
N3n |
N |
|
Amonyum |
N4n |
N |
|
Fosfat |
N1p |
P |
|
Silikat |
N5s |
Si |
|
Oksijen |
O2o |
O2 |
Modelin
çözüm yaptığı derinlikler ölçümlerle karşılaştırıldıklarında çok sayıdadır ve
ölçümlerle aynı noktalarda değildirler. Bu nedenle model başlangıç koşulları 15
Ağustos 2016 tarihli ETS seferinde yapılan ölçümlerden doğrusal enterpolasyon
yoluyla elde edilmiştir. Bu yöntem kapsamında ölçüm yapılan derinliklerin ![]() ile ve bu derinliklerde ölçülen değerlerin
ile ve bu derinliklerde ölçülen değerlerin ![]() ile temsil edildiği, modelin çözüm yaptığı derinlikerin
ile temsil edildiği, modelin çözüm yaptığı derinlikerin ![]() ile ve bu derinliklerdeki model değerlerinin ise
ile ve bu derinliklerdeki model değerlerinin ise ![]() ile temsil edilmeri durumunda modele başlangıç koşulu
olarak kullanılacak değerler aşağıdaki formül ile hesaplanabilir.
ile temsil edilmeri durumunda modele başlangıç koşulu
olarak kullanılacak değerler aşağıdaki formül ile hesaplanabilir.
![]() (
(![]()
Bu
formül model ve ölçüm derinliklerinin ![]() denklemine uyacak şekilde sıralandığını varsaymaktadır.
denklemine uyacak şekilde sıralandığını varsaymaktadır.
Simülasyonunun bitiş tarihi bir yıllık örnekleme döneminin sonuna denk gelen 14 Ağustos 2017’dir. Fitoplankton grupları için gereken başlangıç koşulları proje kapsamında tür bazında yapılan bolluk ölçümlerinin, Akdeniz’de bu türler için ölçülen biyohacim değerlerinin (Arin vd., 2002; Fanuko ve Valcıc, 2009) ve biyohacim ile karbon ve azot biyokütlesi ilişkisini tanımlayan bir çalışmanın (Menden-Deuer ve Lessard, 2000) aracılığıyla hesaplanmıştır. Diatomların modelde kendi başına bir fonksiyonel grup teşkil etmelerinden dolayı bu grup için yapılan Diaton ölçümleri kullanılmıştır. Modelde başka bir grup olan mikrofitoplankton değerleri ölçülen diktiyofitoplankton ve dinoflagellatların bolluklarının toplamından elde edilmiştir. Nanofitoplankton, kokolit ve kriptofit bollukları toplanarak hesaplanmıştır. Pikofitoplankton bulluğu için ise siyanobakteri ölçümleri kullanılmıştır.
Proje önerisinde ETS kapsamında (projede yapılacak ölçümler dışında) ölçüleceği belirtilen zooplankton bollukları ölçülememiştir. Bu nedenle zooplankton türleri için başlangıç koşulları toplam fitoplankton karbon kütlesinin üçe bölünerek üç zooplankton öğesine eşit şekilde dağıtılması yoluyla elde edilmiştir. Zooplankton azot ve fosfor içerikleri Redfield oranı kullanılarak hesaplanmıştır (Redfield vd., 1963).
Organik madde ve inorganik besin tuzu başlangıç koşulları için ise proje kapsamında yapılan ölçümler kullanılmıştır. Partikül Organik Madde’nin boy dağılımı ölçülmediği için ölçülen değerler bu üç gruba eşit dağıtılmıştır.
Modelde bentik bileşenleri temsil eden öğelerin veri eksikliği nedeniyle çözülmemesi modelin deniz dibi – su kolonu arayüzünde gerçekçi olamayan dinamiklere neden olabilir. Örneğin Partikül Organik Madde modelin en derin ızgara noktasında birikip remineralizasyon nedeniyle burada yüksek amonyak derişimi görülebilir. Bu eksikliği gidermek amacı ile modelin 150m ve altındaki ızgara noktalarında bazı model öğeleri ölçümlere doğru rahatlatma yöntemi ile itilmiştir. Ölçümlere doğru itilen model öğeleri nitrat, amonyum, fosfat, silikat, çözünmüş ve partikül organik maddedir. Model su kolonunda 150m ve üzerindeki ızgara noktalarında tamamen serbest çalıştırılmıştır.
Optimizasyon tabanlı parametre tayini
Biyojeokimyasal modellerin tahmin başarısını düşüren faktörlerden en önemlisi modellerin içerdiği onlarca parametrenin değerlerinin yüksek doğrulukta bilinmemesidir. Bu parametrelerin modellerde kullanımı genellikle yaklaşık değerlerin literatürden bulunması ve modelin ölçümlerle uymasını sağlamak için manuel olarak ayarlanmaları ile yapılır. Bu süreç zor ve zaman alan bir süreçtir ve ortaya çıkan parametrelerin değerlerinin doğruluğu şüphe içermektedir. Proje kapsamında yapılan sık aralıklarla ve birçok farklı model öğesini içeren ölçümler parametre tahminini bir algoritma aracılığıyla otomatize etmek için önemli bir fırsat sağlamaktadır.
Proje
kapsamında parametre tahmini ücretsiz ve açık kaynaklı bir yazılım olan PEST
(Model-Independent Parameter Estimation and Uncertainty Analysis) kullanılarak
yapılmıştır (Doherty, 2015). PEST’in ana amacı modelle ölçümlerin farkını ölçen
objektif fonksiyonunu minimize eden parametreleri bulmaktır. ![]() ölçülen değerleri,
ölçülen değerleri, ![]() ölçüm yapılan derinlik ve zamandaki model tahminlerini ve
ölçüm yapılan derinlik ve zamandaki model tahminlerini ve ![]() toplam ölçüm veri noktası sayısını temsil ettiği taktirde
objektif fonksiyonunun tanımı aşağıdaki gibidir:
toplam ölçüm veri noktası sayısını temsil ettiği taktirde
objektif fonksiyonunun tanımı aşağıdaki gibidir:
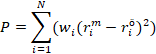
Bu
denklemde ![]() kullanıcı tarafından her bir veri noktasına verilen
ağırlıktır. PEST bu fonksiyonu iteratif bir şekilde minimize etmeye çalışır.
Her iterasyonda PEST objektif fonksiyonunun tahmini yapılması istenen her bir
parametreye göre türevini alır ve dolayısıyla objektif fonksiyonunun Jakobi
matrisini hesaplar. Bu matris objektif fonksiyonunun parametre uzayında lokal
olarak hangi yöne gidildiğinde düşeceğini gösterir ve PEST parametre uzayında
bu yöne adım atarak yeni bir parametre seti elde eder. Yeni parametreler
kullanılarak objectif fonksiyonu tekrar hesaplanır. Fonksiyonda bir azalma var
ise, PEST yeni bir itarasyon başlatır ve tahmin sürecine devam eder, eğer bir
azalma yok ise PEST tahmin sürecini durdurur.
kullanıcı tarafından her bir veri noktasına verilen
ağırlıktır. PEST bu fonksiyonu iteratif bir şekilde minimize etmeye çalışır.
Her iterasyonda PEST objektif fonksiyonunun tahmini yapılması istenen her bir
parametreye göre türevini alır ve dolayısıyla objektif fonksiyonunun Jakobi
matrisini hesaplar. Bu matris objektif fonksiyonunun parametre uzayında lokal
olarak hangi yöne gidildiğinde düşeceğini gösterir ve PEST parametre uzayında
bu yöne adım atarak yeni bir parametre seti elde eder. Yeni parametreler
kullanılarak objectif fonksiyonu tekrar hesaplanır. Fonksiyonda bir azalma var
ise, PEST yeni bir itarasyon başlatır ve tahmin sürecine devam eder, eğer bir
azalma yok ise PEST tahmin sürecini durdurur.
Parametre tahmin sürecinde kullanılan veri setleri, ölçülen derinlikler ve bu verilerin tekabül ettiği model öğeleri Tablo 6’da verilmiştir. Bu veri setleri tüm veri setleri arasından göreceli güvenilirlikleri ve modelde bu sete denk gelen öğelerin varlığı göz önünde bulundurularak seçilmiştir. Tahmilleri yapılmak üzere seçilen biyojeokimyasal model parametreleri, bunların başlangıç değerleri ve kullanıcı tarafından biçilen üst ve alt limitleri Tablo 7’de gösterilmiştir. Tahmini yapılması istenen parametreler tüm parametreler arasından literatürde var olup olmadıkları, ölçülen model öğelerinin denklemlerinde var olup olmamaları ve biliniyorsa doğadaki değişkenlikleri düşünülerek seçilmiştir. Objektif fonksiyonunda kullanılan ağırlıklar veri setlerinin standart sapması hesaplanarak bunların bire bölünmesiyle elde edilmiştir, böylece birim farklılıklarından doğan ağırlık farkları minimize edilerek her bir veri setine optimizasyon algoritması tarafından aynı önemin verilmesi sağlanmıştır.
Parametre tahmini bittikten sonra değerleri bulunan parametreler kullanılarak model çalıştırılmıştır ve modelin tahmin ettiği nitrifikasyon hızı, proje kapsamında elde edilen gerçek hız verileri ile karşılaştırılmıştır.
Tablo 6. Parametre tahmini yapılırken kullanılan veri setleri, verilerin ölçüldüğü derinlikler ve tekabül ettikleri model öğeleri
|
Veri Seti |
Ölçülen Derinlikler (m) |
Model Öğesi |
|
Diatom Karbon Biyokütlesi |
0,25,50,100,250,200 |
P1_c |
|
Mikrofitoplankton Karbon Biyokütlesi |
0,25,50,100,250,200 |
P2_c |
|
Nanofitoplankton Karbon Biyokütlesi |
0,25,50,100,250,200 |
P3_c |
|
Pikofitoplankton Karbon Biyokütlesi |
0,25,50,100,250,200 |
P4_c |
|
Heterotrofik Bakteri Karbon Biyokütlesi |
0,25,50,100,250,200 |
B1_c |
|
Toplam Klorofil |
0,10,25,50,75,100,150,200 |
P1-4 Klorofil İçeriği Toplamı |
|
Çözünmüş Oksijen |
0,10,25,50,75,100,150,200 |
O2o |
|
Nitrat |
0,10,25,50,75,100,150,200 |
N3n |
|
Amonyum |
0,10,25,50,75,100,150,200 |
N4n |
|
Fosfat |
0,10,25,50,75,100,150,200 |
N1p |
|
Silikat |
0,10,25,50,75,100,150,200 |
N5s |
|
Toplam Fosfor |
0,25,50,100,250,200 |
Tüm öğelerin fosfor içerik toplamı |
|
Toplam Azot |
0,25,50,100,250,200 |
Tüm öğelerin fosfor içerik toplamı |
Tablo 7. Tahmini yapılan model parametreleri
|
Parametre |
Sembol |
Birim |
Başlangıç Değeri |
Alt Limit |
Üst Limit |
|
Nitrifikasyon
|
|||||
|
Q10 sıcaklık çarpanı |
'NITq10' |
- |
2 |
1,5 |
3 |
|
Maximum nitrifikasyon hızı |
'NITsN4N3' |
1/gün |
0,5 |
0,0001 |
10 |
|
Oksijen limitasyonu için Michaelis-Menten parametresi |
'NITchN3o' |
(mmol O2/m3)3
|
2700 |
1 |
10000 |
|
Amonyum limitasyonu için Michaelis-Menten parametresi dependence of nitrification |
'NITchN4n' |
(mmol N/m3)3
|
0,5 |
0,01 |
1 |
|
Organik Madde |
|||||
|
Küçük partikül organik maddenin çöküş hızı |
'R4rm' |
m/gün |
1 |
0,5 |
3 |
|
Orta boy partikül organik maddenin çöküş hızı |
'R6rm' |
m/gün |
5 |
3 |
10 |
|
Büyük partikül organik maddenin çöküş hızı |
'R8rm' |
m/gün |
10 |
7 |
20 |
|
Heterotrofik Bakteri |
|||||
|
Q10 sıcaklık çarpanı |
'B1q10' |
- |
2.95 |
2 |
6 |
|
Oksijen limitasyonu için Michaelis-Menten parametresi |
'B1chdo' |
mmol O/m3
|
0,31 |
0,1 |
1 |
|
Nitrat limitasyonu için Michaelis-Menten parametresi |
'B1chn' |
mmol N/m3
|
0,5 |
0,1 |
1 |
|
Fosfat limitasyonu için Michaelis-Menten parametresi |
'B1chp' |
mmol P/m3
|
0,1 |
0,01 |
1 |
|
Referans sıcaklıkta maksimum ölüm hızı |
'B1sd' |
1/gün |
0,05 |
0,01 |
0,1 |
|
Referans sıcaklıkta maksimum büyüme hızı |
'B1sum' |
1/gün |
8,38 |
5 |
10 |
|
Referans sıcaklıkta sulunum hızı |
'B1srs' |
1/gün |
0,01 |
0,01 |
0,1 |
|
Çözünmüş organik madde için maksimum dönüşüm hızı |
'B1sR1' |
1/gün |
0,0001 |
1,00E-05 |
1 |
|
Maksimum fosfor karbon oranı |
'B1qpc' |
mmol P/mg C |
0,0019 |
0,001 |
0,0025 |
|
Maksimum azot karbon oranı |
'B1qnc' |
mmol N/mg C |
0,0167 |
0,01 |
0,02 |
|
Değişken çözünmüş organik fosforun mineralizasyon hızı |
'B1sR1N1' |
1/gün |
0,0001 |
1,00E-05 |
1 |
|
Değişken çözünmüş organik azotun mineralizasyon hızı |
'B1sR1N4' |
1/gün |
0,0001 |
1,00E-05 |
1 |
|
Küçük partikül organik maddenin çözünmüş organik maddeye dönüşüm hızı |
'B1sRP1R1' |
1/gün |
0,01 |
0,005 |
0,02 |
|
Orta boy partikül organik maddenin çözünmüş organik maddeye dönüşüm hızı |
'B1sRP2R1' |
1/gün |
0,0025 |
0,001 |
0,01 |
|
Büçük partikül organik maddenin çözünmüş organik maddeye dönüşüm hızı |
'B1sRP3R1' |
1/gün |
0,001 |
0,0005 |
0,005 |
|
Diatom |
|||||
|
Referans sıcaklıkta maksimum büyüme hızı |
'P1sum' |
1/gün |
2,5 |
1,5 |
3,5 |
|
Q10 sıcaklık çarpanı |
'P1q10' |
- |
2 |
1,5 |
3 |
|
Referans sıcaklıkta sulunum hızı |
'P1srs' |
1/gün |
0,1 |
0,05 |
0,2 |
|
Birincil üretimin salgılanan oranı |
'P1pu_ea' |
- |
0,05 |
0,01 |
0,5 |
|
Birincil üretimin solunan oranı |
'P1pu_ra' |
- |
0,1 |
0,05 |
0,5 |
|
Minimum azot karbon oranı |
'P1qnlc' |
mmol N/mg C |
0,00687 |
0,001 |
0,01 |
|
Minimum fosfor karbon oranı |
'P1qplc' |
mmol P/mg C |
0,0004288 |
0,0001 |
0,001 |
|
Fosfor limitasyon eşiği (Redfield oranına kıyasla) |
'P1xqcp' |
- |
1 |
0,2 |
1 |
|
Azot limitasyon eşiği (Redfield oranına kıyasla) |
'P1xqcn' |
- |
1 |
0,5 |
1 |
|
Maksimum fosfor karbon oranı |
'P1xqp' |
- |
2 |
1 |
2 |
|
Maksimum azot karbon oranı |
'P1xqn' |
- |
2 |
1 |
3 |
|
Nitrat afinitesi |
'P1qun3' |
m3/mg C/gün |
0,0025 |
0,0001 |
0,1 |
|
Amonyum afinitesi |
'P1qun4' |
m3/mg C/gün |
0,0025 |
0,0001 |
0,1 |
|
Fosfat afinitesi |
'P1qurp' |
m3/mg C/ gün |
0,003 |
0,0001 |
0,1 |
|
Besinlerin lüks alımının maksimum kotaya doğru spesifik eğilimi |
'P1snplux' |
1/gün |
1 |
0,1 |
2 |
|
Maksimum silikon karbon oranı |
'P1qsc' |
mmol Si/mg C |
0,0118 |
0,005 |
0,02 |
|
Silikat limitasyonu için Michaelis-Menten parametresi |
'P1chs' |
mmol/m3 |
0,1 |
0,01 |
0,5 |
|
Minimum liziz hızı |
'P1sdo' |
1/gün |
0,05 |
0,04 |
0,06 |
|
PI-eğrisinin başlangıç eğimi |
'P1alpha' |
mg C m2/mg Chl/W/gün |
4 |
3 |
6 |
|
Fotoinhibisyon parametresi |
'P1beta' |
mg C m2/mg Chl/W/gün |
0,07 |
0,01 |
0,2 |
|
Fotosentez için maksimum efektif klorofil karbon oranı |
'P1phim' |
mg Chl/mg C
|
0,06 |
0,001 |
0,06 |
|
Besin limitasyonundan doğan maksimum çökme hızı |
'P1resm' |
m/gün |
5 |
0,2 |
20 |
|
Çökmenin başladığı minimum besin seviyesi |
'P1esni' |
- |
0,7 |
0,1 |
2 |
|
Nanofitoplankton |
|||||
|
Referans sıcaklıkta maksimum büyüme hızı |
'P2sum' |
1/gün |
3 |
1,5 |
3,5 |
|
Q10 sıcaklık çarpanı |
'P2q10' |
- |
2 |
1,5 |
3 |
|
Referans sıcaklıkta sulunum hızı |
'P2srs' |
1/gün |
0,05 |
0,01 |
0,05 |
|
Birincil üretimin salgılanan oranı |
'P2pu_ea' |
- |
0,1 |
0,05 |
0,5 |
|
Birincil üretimin solunan oranı |
'P2pu_ra' |
- |
0,1 |
0,05 |
0,5 |
|
Minimum azot karbon oranı |
'P2qnlc' |
mmol N/mg C |
0,00687 |
0,001 |
0,01 |
|
Minimum fosfor karbon oranı |
'P2qplc' |
mmol P/mg C |
0,0004288 |
0,0001 |
0,001 |
|
Fosfor limitasyon eşiği (Redfield oranına kıyasla) |
'P2xqcp' |
- |
1 |
0,2 |
1 |
|
Azot limitasyon eşiği (Redfield oranına kıyasla) |
'P2xqcn' |
- |
1 |
0,5 |
1 |
|
Maksimum fosfor karbon oranı |
'P2xqp' |
- |
2 |
1 |
2 |
|
Maksimum azot karbon oranı |
'P2xqn' |
- |
1,075 |
1 |
3 |
|
Nitrat afinitesi |
'P2qun3' |
m3/mg C/gün |
0,004 |
0,0001 |
0,1 |
|
Amonyum afinitesi |
'P2qun4' |
m3/mg C/ gün |
0,004 |
0,0001 |
0,1 |
|
Fosfat afinitesi |
'P2qurp' |
m3/mg C/ gün |
0,004 |
0,0001 |
0,1 |
|
Besinlerin lüks alımının maksimum kotaya doğru spesifik eğilimi |
'P2snplux' |
1/gün |
1 |
0,1 |
2 |
|
Minimum liziz hızı |
'P2sdo' |
1/gün |
0,05 |
0,04 |
0,06 |
|
PI-eğrisinin başlangıç eğimi
|
'P2alpha' |
mg C m2/mg Chl/W/gün |
5 |
3 |
6 |
|
Fotoinhibisyon parametresi |
'P2beta' |
mg C m2/mg Chl/W/gün |
0,1 |
0,01 |
0,2 |
|
Fotosentez için maksimum efektif klorofil karbon oranı |
'P2phim' |
mg Chl/mg C |
0,025 |
0,012 |
0,025 |
|
Pikofitoplankton |
|||||
|
Referans sıcaklıkta maksimum büyüme hızı |
'P3sum' |
1/gün |
3,5 |
1,5 |
3,5 |
|
Q10 sıcaklık çarpanı |
'P3q10' |
- |
2 |
1,5 |
3 |
|
Referans sıcaklıkta sulunum hızı |
'P3srs' |
1/gün |
0,1 |
0,01 |
0,2 |
|
Birincil üretimin salgılanan oranı |
'P3pu_ea' |
- |
0,1 |
0,05 |
0,2 |
|
Birincil üretimin solunan oranı |
'P3pu_ra' |
- |
0,2 |
0,05 |
0,2 |
|
Minimum azot karbon oranı |
'P3qnlc' |
mmol N/mg C
|
0,00687 |
0,001 |
0,01 |
|
Minimum fosfor karbon oranı |
'P3qplc' |
mmol P/mg C |
0,0004288 |
0,0001 |
0,001 |
|
Fosfor limitasyon eşiği (Redfield oranına kıyasla) |
'P3xqcp' |
- |
1 |
0,2 |
1 |
|
Azot limitasyon eşiği (Redfield oranına kıyasla) |
'P3xqcn' |
- |
1 |
0,5 |
1 |
|
Maksimum fosfor karbon oranı |
'P3xqp' |
- |
1,5 |
1 |
1,5 |
|
Maksimum azot karbon oranı |
'P3xqn' |
- |
1,05 |
1 |
3 |
|
Nitrat afinitesi |
'P3qun3' |
m3/mg C/gün |
0,006 |
0,0001 |
0,1 |
|
Amonyum afinitesi |
'P3qun4' |
m3/mg C/ gün |
0,007 |
0,0001 |
0,1 |
|
Fosfat afinitesi |
'P3qurp' |
m3/mg C/ gün |
0,006 |
0,0001 |
0,1 |
|
Besinlerin lüks alımının maksimum kotaya doğru spesifik eğilimi |
'P3snplux' |
1/gün |
1 |
0,1 |
2 |
|
Minimum liziz hızı |
'P3sdo' |
1/gün |
0,055 |
0,04 |
0,06 |
|
PI-eğrisinin başlangıç eğimi |
'P3alpha' |
mg C m2/mg Chl/W/gün |
6 |
3 |
6 |
|
Fotoinhibisyon parametresi |
'P3beta' |
mg C m2/mg Chl/W/gün |
0,12 |
0,01 |
0,2 |
|
Fotosentez için maksimum efektif klorofil karbon oranı |
'P3phim' |
mg Chl/mg C |
0,015 |
0,0079 |
0,015 |
|
Mikrofitoplankton |
|||||
|
Referans sıcaklıkta maksimum büyüme hızı |
'P4sum' |
1/gün |
1,5 |
1,5 |
3,5 |
|
Q10 sıcaklık çarpanı |
'P4q10' |
- |
2 |
1,5 |
3 |
|
Referans sıcaklıkta sulunum hızı |
'P4srs' |
1/gün |
0,1 |
0,01 |
0,2 |
|
Birincil üretimin salgılanan oranı |
'P4pu_ea' |
- |
0,15 |
0,05 |
0,2 |
|
Birincil üretimin solunan oranı |
'P4pu_ra' |
- |
0,1 |
0,05 |
0,2 |
|
Minimum azot karbon oranı |
'P4qnlc' |
mmol N/mg C |
0,00687 |
0,001 |
0,01 |
|
Minimum fosfor karbon oranı |
'P4qplc' |
mmol P/mg C |
0,0004288 |
0,0001 |
0,001 |
|
Fosfor limitasyon eşiği (Redfield oranına kıyasla) |
'P4xqcp' |
- |
1 |
0,2 |
1 |
|
Azot limitasyon eşiği (Redfield oranına kıyasla) |
'P4xqcn' |
- |
1 |
0,5 |
1 |
|
Maksimum fosfor karbon oranı |
'P4xqp' |
- |
2,7 |
1 |
3 |
|
Maksimum azot karbon oranı |
'P4xqn' |
- |
1,1 |
1 |
3 |
|
Nitrat afinitesi |
'P4qun3' |
m3/mg C/gün |
0,002 |
0,0001 |
0,1 |
|
Amonyum afinitesi |
'P4qun4' |
m3/mg C/ gün |
0,002 |
0,0001 |
0,1 |
|
Fosfat afinitesi |
'P4qurp' |
m3/mg C/ gün |
0,002 |
0,0001 |
0,1 |
|
Besinlerin lüks alımının maksimum kotaya doğru spesifik eğilimi |
'P4snplux' |
1/gün |
1 |
0,1 |
2 |
|
Minimum liziz hızı |
'P4sdo' |
1/gün |
0,045 |
0,04 |
0,06 |
|
PI-eğrisinin başlangıç eğimi |
'P4alpha' |
mg C m2/mg Chl/W/gün |
3 |
3 |
6 |
|
Fotoinhibisyon parametresi |
'P4beta' |
mg C m2/mg Chl/W/gün |
0,06 |
0,01 |
0,2 |
|
Fotosentez için maksimum efektif klorofil karbon oranı |
'P4phim' |
mg Chl/mg C |
0,045 |
0,01 |
0,045 |